|
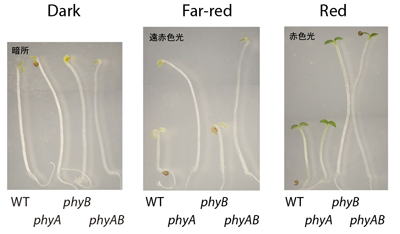
フィトクロムの主要な分子種としてphyAとphyBが知られる。我々は、ゲノム情報がまだ整わない時代からこの問題に取り組んできた。まず、シロイヌナズナを材料にphyB変異体の同定に寄与するとともに、phyAの変異体を自ら単離した。さらに、トマトやエンドウのフィトクロム変異体の解析をオランダのグループと共同で行った(van Tuinen et al., 1995a, b, 1996; Weller et al., 1995; Kerckhoffs et al., 1997など)。
フィトクロム欠損変異体
(長谷撮影)
phyAとphyBの変異体を用いることにより、それぞれの分子種の生理的な役割を明らかにすることが可能になった。これを利用して、光発芽においてphyAとphyBの応答の作用スペクトルが大きく異なり、phyAが古くより知られる超弱光反応の光受容体であることを証明した(Shinomura et al., 1996)。また、これらの変異体を用いて、フィトクロムの根の緑化における役割(Usami et al., 2004; Usami et al., 2007)、葉の扁平化における役割(Kozuka et al., 2013)などを示してきた。
これらの変異体は、フィトクロム研究に欠かせない資源と広く認識されるに至った。我々は、これらの変異体を用いて、様々な分野の研究者と光応答に関する共同研究を行っている(Batschauer et al., 1996; Genoud et al., 1998; Cerdan et al. 1999, Yamamoto et al., 2003; Tamura et al., 2003; 他多数)。
フィトクロム 研究topへ
|
フィトクロムは水溶性であることから、長い間細胞質で機能すると考えられていた。しかし我々は、GUS融合タンパク質を用いて、phyBのC-末端ドメインに核移行活性があることを初めて示した(Sakamoto & Nagatani, 1996a)。さらに、GFPを用いて完全長のphyBが光に応答して核内に移行し、核内で顆粒状の構造体を形成することを示した(Yamaguchi et al., 1999)。また、日立製作所のグループの古谷らのグループと共同で、エンドウにおいてphyAが光依存的に核内に移行することを免疫化学的にしめした(Hisada et al., 2000)。これらの研究により、フィトクロムのシグナル伝達における重要なステップが明らかとなった。
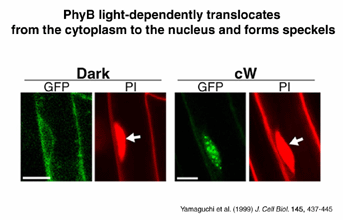
(写真はMatsushita et al., 2003にもとづく)
上記の研究が行われたのとちょうど同じ頃、米国のQuailらのグループにより、フィトクロムが転写因子と物理的に相互作用することが示され、フィトクロムは核内でシグナルを伝達すると考えられるようになった。さらに最近では、phyAが核内でユビキチン化されることを示す共同研究を行い、核がphyAの分解の場でもあることを示した(Seo et al., 2004)。また、PIFの発見者であるQuailらと共同で、とフィトクロムとPIFの相互作用に関する共同研究を行った(Kikis et al.k 2009)。
フィトクロム 研究topへ
|
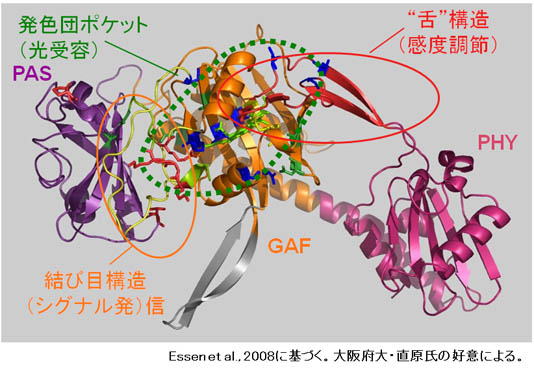
フィトクロムのN-末端側ドメインは発色団を結合し光に応答したPr-Pfr型光変換を示す。一方、C-末端側ドメインは2量体化を担う。さらに、C-末端側にドメイン内に、PASドメインやキナーゼドメインが認められるため、フィトクロムはC-末端側ドメインよりシグナルを発信すると考えられてきた。しかしながら、C-末端を単独で発現させた植物で顕著な表現型は認められなかった(Sakamoto & Nagatani, 1996b)。
我々は、上記の結果から7年後、この問題に関する重要な結果を得た。phyBのN-末端側ドメインを2量体化して核に局在させると、ほとんど正常な光受容体として機能した(Matsushita et al., 2003)。この結果、永年の「常識」に反して、C-末端ドメインは光シグナルの伝達に必ずしも必要ないことが明らかとなった。
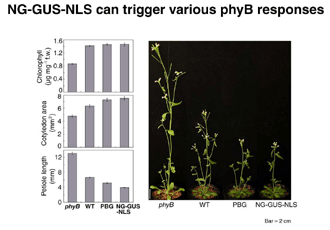
(写真はMatsushita et al., 2003にもとづく)
上記の結果を受け、さらに短くしたN-末端側ドメインの生理活性を調べた結果、N-末端側ドメイン内のC-末端側に存在する約200アミノ残基よりなるPHYドメインを除いても光受容体として機能することを示した(Oka et al., 2004)。他の研究グループの結果と合わせると、核内でのシグナル伝達に本質的に必要なのは、フィトクロムを構成する約1100アミノ酸残基のうちわずか350アミノ酸残基程度と考えられる。
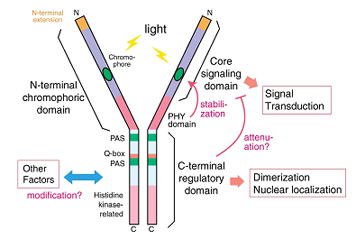
我々は、N-末端側ドメイン内でphyBの機能発現に関与するアミノ酸残基を特定するため、当該ドメインを発現する植物に変異を導入し、応答が低下した変異株の大規模スクリーニングを行った(Oka, Matsushita et al., 2008)。得られた株の中から、導入phyB断片にアミノ酸置換が認められるものを選別し、それぞれの変異phyB断片の性質を調べた。その結果、分光光学的性質を損なう変異は、N-末端側ドメイン内のサブドメインのうち、GAFドメインとPHYドメインに集中していた。一方、フィトクロムに特徴的な構造である"light sensing knot"の近傍に、分光光学的性質を損なうことなくシグナル伝達に影響する複数の変異を見出した。この結果は、フィトクロムのN-末端側ドメインからのシグナル発信に"light sensing knot"が関わることを示唆する非常に興味深い結果である。
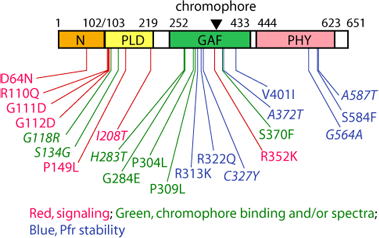
さらに、米国のQuail研と共同研究により、上記のシグナル伝達に関わるアミノ酸残基が、フィトクロムと相互作用してシグナルを伝達するbHLH型の転写因子であるPIF3との結合にも関わることが明らかとなった(Kikis, Oka et al., 2008)。従って、フィトクロムはN-末端突出部、PAS、"light sensing knot"などの特定の表面構造を介してシグナル伝達を行っていると想像される。
フィトクロム 研究topへ
|
我々は、フィトクロムを4つの部位にわけ、phyAとphyBの間でそれぞれの部位を交換するphyA/phyBキメラタンパク質を構築し、植物に遺伝子導入してその性質を調べてきた。その結果、phyAが示す様々な特徴は、異なる部位のphyA配列が決めていることが明らかとなった。すなわち、phyA分子は、様々な特徴をもつモジュールが組み合わさった分子と捉えられることが分かった(Oka, Ono et al., 2012)。
 フィトクロム 研究topへ
フィトクロム 研究topへ
|
|
フィトクロムと相互作用して花芽形成を制御するPHL
|
長日植物であるシロイヌナズナにおいては、フィトクロムB(phyB)によって花芽形成が抑制されることが知られている。我々は、京都大学・荒木崇教授、遠藤求助教らと共同で、この制御に関わる新奇因子PHLを同定し、その機能を詳しく調べた。その結果、PHLがphyBの機能を制限することで花芽形成を早めていることが分かった。また、phyB, PHLに加えて、その下流で花芽形成の制御を行っていると考えられてきたCOの三種のタンパク質が核内で複合体を形成することを示す結果を得た(Endo et al., 2013)。これらの結果は、これまで不明であったフィトクロムによる花芽形成制御の分子機構に関する重要な知見である。
フィトクロム 研究topへ
|
これまでに行ってきたフィトクロム分子の構造/機能解析や、最近のフィトクロム(バクテリア・フィトクロム)の立体構造の解明により、フィトクロム分子上のどのような構造がどのような機能と関わるかを示す構造/機能マップが明らかになりつつある。これを利用して、京都大学・瀬戸口浩彰博士のグループ、岡山大・池田啓博士らと共同で、フィトクロムの自然変異に機能的な意義付けをすることを試みている。
フィトクロム 研究topへ
|
|